马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
本帖最后由 fqb1983 于 2020-3-4 09:09 编辑 * ]0 C; {& U9 v! t) E' x0 d3 i$ F) g
! i# G1 T# L7 b* `% O5 N
昨天看到这么一篇文章,有没有专家确认下?
3 c* K" ]' U6 y3 u2 f# y2 }原文标题:免疫治疗再经波澜——当免疫治疗遇上抗生素2 L: p: Q; m+ O l0 K' _4 h$ o
抗生素与免疫治疗——水火不容
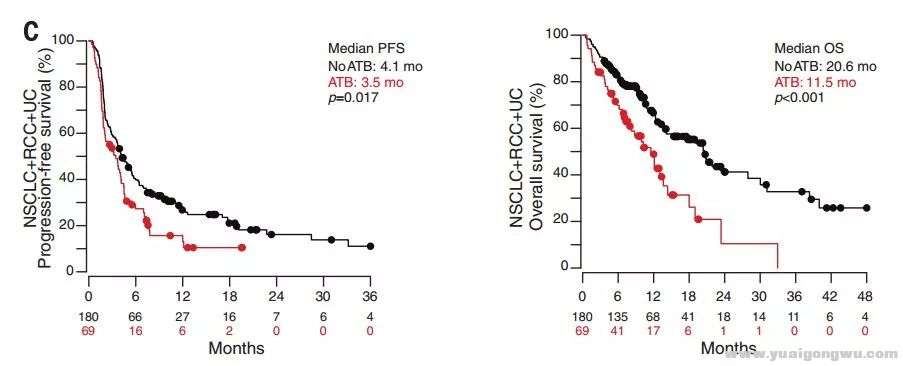
4 }; M* f, |. R; R1 b* L4 S0 G3 v4 X/ z$ v0 DScience发布的一项法国研究探讨了广谱抗生素(ATB,即β-内酰胺类、喹诺酮类、大环内酯内)对249例晚期肿瘤患者接受anti-PD-1/PD-L1疗效的影响,包括进展期非小细胞肺癌(NSCLC)140例、肾细胞癌(RCC)67例、尿路上皮癌(UC)42例。在249例患者中69位患者在免疫治疗前的2个月内或治疗后1个月进行抗生素治疗。$ R8 M; J8 P/ E- P/ C" _" I
, g3 i @# I! d, r
0 _8 f7 a- [2 x* I
7 W* V' |# M( |' Q$ P4 N. A分析结果表明,与未服用抗生素并接受免疫治疗组(NoATB组)相比,服用抗生素并接受免疫治疗组(ATB组)的中位PFS(mPFS)降低0.6个月(NoATB:ATB= 4.1 mo vs 3.5mo, p=0.017),中位OS(mOS)降低9.1个月(ATB : NoATB=11.5 mo vs 20.6mo, p<0.001)。$ L6 G8 q: n, L# }; z
( m! t& o* F- X6 L
/ O" x; b3 W; K) }8 n8 I
7 R, ?9 w: m1 V; o" ~ f0 A
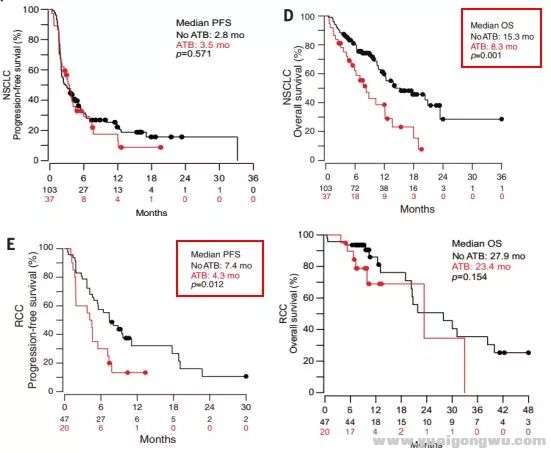
9 w, b; Z! C8 Q$ h7 n/ ?5 ]单一瘤种分析显示,与NoATB组相较,NSCLC中ATB组的mOS降低7个月(ATB : NoATB=8.3 mo vs 15.3 mo, p=0.001);RCC中ATB组的mPFS降低3.9个月(ATB : NoATB=4.3 mo vs 7.4 mo, p=0.012);UC中ATB组的mPFS、mOS均呈下降趋势(mPFS:ATB : NoATB=1.8 mo vs 4.3 mo, p=0.049;mOS:ATB : NoATB=11.5 mo vs未达到, p=0.098)。: V0 K( W; h' n9 Z6 I. s. k$ X* ^5 P
) M6 v' |) I2 c& m& j- @
 % f; _3 R. @5 D* W4 n3 @ E
% f; _3 R. @5 D* W4 n3 @ E
 0 s, F3 Y4 a8 ?7 @& y6 ^ K9 S
0 s, F3 Y4 a8 ?7 @& y6 ^ K9 S
) ~5 H. H/ m+ h0 v$ H% Q1 t
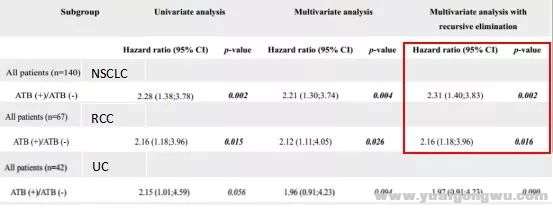
" R/ Z8 j. @* I6 J6 `单变量和多变量COX回归分析显示,抗生素治疗是NSCLC、RCC患者接受PD-1抑制剂产生原发耐药的独立预后因子(NSCLC:HR=2.31,95%CI:1.40-3.83,p=0.002;RCC:HR=2.16,95%CI:1.18-3.96,p=0.016)。* k( I: K5 U3 Y n2 z& x0 L# C
& j8 a7 p. C5 g7 g
 % W7 B) h" |! m8 Q8 \
% W7 B) h" |! m8 Q8 \
$ E7 x* b1 m( g) L2017年的生殖泌尿肿瘤研讨会上报道了关于ATB对转移性肾细胞癌(mRCC)免疫治疗疗效的研究。该研究共入组80例单独应用PD-L1抑制剂或联合其它治疗的mRCC患者,按照治疗前1个月内是否应用过抗生素分为ATB+组和ATB-组,其中16例患者接受ATB(大部分是β-内酰胺酶类或喹诺酮类)治疗。# H% a* i' @# u
# W# U. r1 z3 e
0 Z+ }$ N4 Q9 ~, u& h; N F结果显示,接受免疫治疗患者中,接受抗生素治疗组的PFS较未接受抗生素治疗组的PFS缩短5.8个月(2.3个月 vs 8.1个月,p<0.001),ORR显著降低(p<0.002)。因随访时间小于6个月,OS数据不成熟,但该研究已显示出抗生素对免疫治疗的负面倾向。3 Y- W3 f7 V4 J* j
1 V8 t* c! A6 p
* P0 |* { h7 ]& \9 E5 S; o; }宿主肠道共生菌群的丰富度——真正的幕后操手# @. |4 E: I/ y# p8 r8 c$ D
2016年Martin J.Blaser等在Science发表的文章指出抗菌素使用会给人体内的正常肠道菌群带来负面影响,并提出收集健康幼儿的粪便,提取菌群可能作为细菌感染的解决方案。因此研究者假想:肠道菌群的微生态失调能否影响免疫检查点抑制剂(ICIs)疗效呢?2018年,Science同期发表了两篇使用ICIs治疗恶性黑色素瘤的文章,揭示了抗生素破坏了肠道菌群的丰富度,首次将肠道共生菌群与ICIs疗效联系在一起。
" t+ @- e7 `' _8 s& o
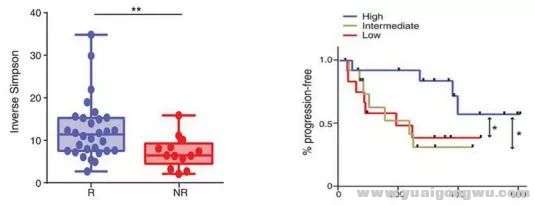
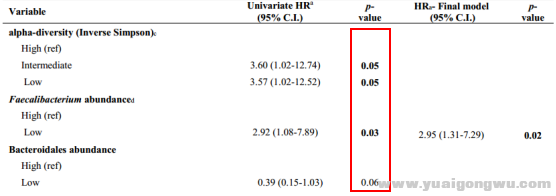
z5 B. w' H) |: t& a1 u7 U* mGopalakrishnan等以112例接受抗PD-1免疫治疗的晚期黑色素瘤患者为研究对象,发现肠道菌群多样性与PD-1抗体的疗效有关。研究显示PD-1抗体治疗有效(R)的30名患者与无效(NR)的13名患者的肠道菌群明显不同,治疗有效者肠道菌群更具多样性,且PFS显著延长(高度多样性:PFS未达到,中度多样性:PFS=232天,低度多样性:PFS=188天,高度 vs 中度多样性:HR=3.60,95%CI 1.02-12.74,p<0.05;中度 vs 低度多样性:HR=3.57,95% CI 1.02-12.52,p<0.05)。
P; [) d% t& F7 Z0 E! u
 [' _8 d% h( y; ^+ O; j1 y
[' _8 d% h( y; ^+ O; j1 y
. y+ X6 B6 D0 A! D1 M! B' x% Z
2 M" k* z& w1 J- `多元COX分析显示,肠道菌群α多样性、肠道菌群构成(粪杆菌属、拟杆菌属)是anti-PD-1疗效预测的有效微生物指标。3 m$ T2 j; C) C4 S
! S4 k; @! G) O; J" P! D; g4 h1 D0 u: }0 A/ B
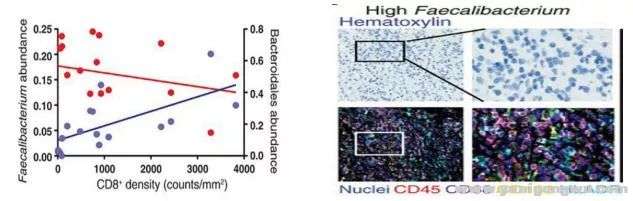
8 H( c: F s) `) B# R8 S# i! Q此外,肠道菌群(例如粪杆菌属)与肿瘤组织内CD8+T细胞的浸润程度显著正相关(r2=0.42,p<0.01)。肠道菌群中粪杆菌属含量高的患者,其肿瘤组织中抗原呈递相关的标记物表达更为丰富。
" w( h. j1 M1 F/ F* N: Y, x
 % f; H' Z9 G2 w
% f; H' Z9 G2 w
) K, \( a; W! _1 L6 J
/ W6 ]5 }- X4 D: r; {- |+ i
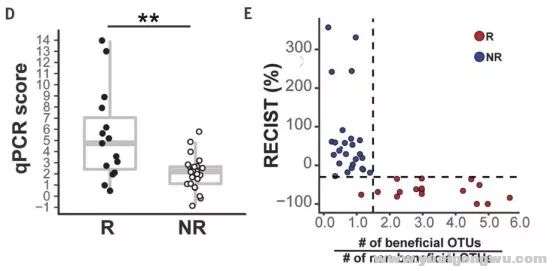
无独有偶,在另一项黑色素瘤的研究中Matson等发现相对于26名免疫治疗无效患者(NR),16名对ICIs有效患者(R)中的肠道菌群含量更具丰富性(包括长双歧杆菌、产气柯林斯菌、屎肠球菌),其中有益菌群/非有益菌群 >1.5 提示免疫治疗疗效更好。
4 L. d& ^- I; k& Z
 ( E. d, y' B9 A# D9 `: b* W
( E. d, y' B9 A# D9 `: b* W
% d i: w, ]# p5 W. K! I, _8 a ^) s# u) O1 q( m
动物实验证明将免疫治疗有效患者的粪便(含有 AKK 菌)移植到无菌条件下饲养的荷瘤小鼠体内,小鼠体内肿瘤的增殖速度不仅延迟,同时也观察到肿瘤微环境中免疫介质的改变:Th1细胞因子IL-12的释放、CCR9/CXCR3+ 的CD4+T细胞在肿瘤组织中募集、CD4+ Treg细胞降低等。 O1 U2 `9 e+ D0 [
0 g. h# g; g8 r2 Z9 }& O4 l
" Q1 o) X7 [9 b! H研究者认为具有良好肠道菌群的患者,可能通过抗原呈递系统产生较强的全身及抗肿瘤免疫应答反应,改善了外周效应T细胞功能和肿瘤微环境。对于肠道菌群不良的患者,其抗原呈递能力较弱,进而导致机体免疫系统和抗肿瘤免疫反应受损。- u- h \" Y5 L' I
+ f! T) q! h* e. I; {5 \
& j) X- E* U7 ?/ h' s7 U! @4 S; o免疫治疗的道路上可以说是波澜起伏。广谱抗生素的近期应用可能对免疫治疗的疗效产生负面冲击,但人体内共生微生物菌群的多样性却使免疫治疗的耐药峰回路转。因此我们需要注意,接受免疫治疗期间尽可能避免抗生素应用,以免破坏肠道菌群的“有力助攻”。未来,揭示免疫治疗、抗生素应用、宿主共生微生物菌群三者间错综复杂的关系,可能有助于使“冷肿瘤”向“热肿瘤”转化,将改变免疫治疗耐药患者疗效与生存。2 H; c7 S& Q1 w7 f% {
& s- w7 w6 N" a- A: J0 R参考文献:4 W1 Y, g4 q- _( R* y z
* W) p2 ?5 s: I( D1. Bertrand Routy, et al., Gut microbiome influences efficacy of PD-1?based immunotherapy against epithelial tumors . Science, 02 Nov 2017.9 n! O5 E( e- M7 l2 }- i, O$ x0 H
) o1 u1 A5 K+ \7 _& L' a2. V. Gopalakrishnan, et al., Gut microbiome modulates response to anti–PD-1 immunotherapy in melanoma patients. Science, 02 Nov 2017.- p* s. d1 e0 U8 {- D$ Q
( M o: Y- L( M$ \5 D# `) ?3. Matson V, et al., The commensal microbiome is associated with anti-PD-1 efficacy in metastatic melanoma patients. Science, 05 Jan 2018.
% }$ C6 ^7 S0 @ u7 R: W
0 u# |, z6 J/ w F, X4 _4 ]4. Blaser MJ, Antibiotic use and its consequences for the normal microbiome. Science, 29 Apr 2016.
! [9 e$ c. X' L$ I& d% y a2 } |